Enzyme sind Eiweißmoleküle (Proteine) die von allen lebenden Zellen und Mikroorganismen gebildet werden. Als Biokatalysatoren sind sie in der Lage, biochemische Prozesse extrem zu beschleunigen, ohne dabei selbst verändert oder verbraucht zu werden. Reaktionen, die mit Enzymen in Millisekunden ablaufen, würden sonst Jahre benötigen.
Wirkungsweise von Enzymen
Die Ausgangsstoffe einer Enzymreaktion (Substrate) werden im aktiven Zentrum des Enzyms gebunden und es entsteht ein Enzym-Substrat-Komplex. Das Enzym verändert die räumliche Struktur des Substrats, wodurch Bindungen gelockert werden. Der Komplex zerfällt und Reaktionsprodukte und das Enzymmolekül werden freigesetzt. Das unveränderte Enzymmolekül kann nun weiter Substratmoleküle umsetzen. Ein Enzym erkennt immer nur ein Substrat und katalysiert genau eine Reaktion. Dies wird als Substrat- und Reaktionsspezifität bezeichnet.
Enzymatische Analyse
Der Begriff der „enzymatischen Analyse“ ist eine Sammelbezeichnung für Methoden, bei denen Enzyme zur Bestimmung eingesetzt werden und umfasst zwei prinzipiell unterschiedliche analytische Verfahrensweisen:
- Die Messung der Enzym-Aktivität mit Hilfe des entsprechenden Substrats
Da Enzyme nur in geringer Konzentration vorliegen, ist es schwierig die Enzymmenge direkt zu bestimmen. Daher wählt man eine indirekte Bestimmungsmethode und ermittelt die Enzymaktivität, d.h. man bestimmt den Substratumsatz pro Zeiteinheit (=Aktivität) unter standardisierten Bedingungen. Die Messung erfolgt fotometrisch.
- Die Messung der Substratkonzentration mit Hilfe des entsprechenden Enzyms
Der Probe wird ein Enzym zugesetzt, das die gesuchte Substanz umsetzt. Dabei entstehen Produkte, die fotometrisch gemessen werden können. Ist die direkte Messung nicht möglich, wird häufig mit gekoppelten enzymatischen Reaktionen gearbeitet.
Nach dieser Methodik finden im CVUA RRW Bestimmungen von Stärke, Glucose, Fructose, Lactose, Saccharose, Apfelsäure, Citronensäure, Ascorbinsäure, Glutaminsäure und weiteren zahlreichen Substanzen statt.
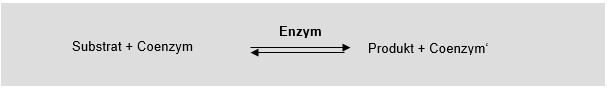
Die enzymatischen Reaktionen verlaufen in der Regel nach folgender Reaktion:
Beispiel: Die quantitative Glucosebestimmung mit Hilfe von Enzymen.
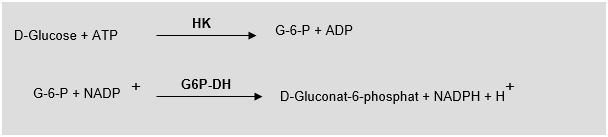
ATP = Adenosin-5’-trophosphat
HK = Enzym Hexokinase
G-6-P = Glucose-6-Phosphat
ADP = Adenosin-5’-diphosphat
NADP = Nicotinamid-adenin-dinucleotidphosphat
G6P-DH = Enzym Glucose-6-phosphat-Dehydrogenase
NADPH = reduziertes Nicotinamid-adenin-dinucleotidphosphat
Glucose wird mit Hilfe des Enzyms Hexokinase umgesetzt, aber weder die Glucose noch das Produkt, das Glucose-6-Phosphat noch die beteiligten Kofaktoren ATP und ADP sind fotometrisch messbar. Das Beispiel zeigt, das manchmal mehrere enzymatische Reaktionen nötig sind, bis ein messbares Reaktionsprodukt entsteht.
Das Produkt der ersten Reaktion (Glucose-6-Phosphat) wird also zum Substrat für die zweite Reaktion. Vermittelt durch das Enzym G-6-P-Dehydrogenase entsteht aus dem Glucose-6-Phosphat das D-Gluconat-6-Phosphat und NADPH und H+.
Die entstandene NADPH - Konzentration ist proportional der Glucose-Konzentration und kann fotometrisch gemessen werden.
Bei enzymatischen Reaktionen können gefärbte Endprodukte entstehen, die im sichtbaren Bereich des Lichtspektrums messbar sind. Sehr häufig entstehen jedoch Produkte, wie in dem oben gezeigten Beispiel, die nur im ultravioletten Bereich messbar sind. Diese Tests werden auch enzymatische UV-Tests genannt.
Enzymatische UV-Tests
Im UV-Test dienen Extinktionsänderungen von Coenzymlösungen als Messgröße. Dabei macht man sich die Eigenschaft der Coenzyme NAD(H) und NADP(H) zunutze, dass sie sich in oxidierter Form bezüglich Lichtabsorption von der reduzierten Form unterscheiden. Bei der enzymatischen Umwandlung entsteht bzw. verschwindet je nach Richtung der Reaktion der Absorptionspeak bei 340 nm.

